In der zweiten Episode dieses Podcasts behandeln wir die MDR (Medical Device Regulation), als rechtliche Grundlage für Hersteller und Inverkehrbringer von Medizinprodukten.
Folgende Themen besprechen wir:
- Erratum
- Wir stellen ein paar Dinge in Bezug auf letzte Folge klar, die so nicht ganz richtig waren. So fordert die MDR nicht explizit ein Risikomanagement nach ISO 14971 oder ein Qualitätsmanagement nach ISO 13485. Sie stellt jedoch Anforderungen daran. Mit der Erfüllung der (harmonisierten) Norm z.B. EN ISO 13485 kann nachgewiesen werden, dass ein Qualitätsmanagement umgesetzt wurde, dass den Anforderungen der MDD und MDR entspricht. Selbiges gilt für die anderen Normen. Man spricht hier dann von der sogenannten Konformitätsvermutung.
- Statistik
- Wir haben für euch die Unterschiede der MDD (deutsch, konsolidiert) und MDR (deutsch) statistisch in einer kleinen Tabelle zusammengefasst:
| # | MDD | MDR | Auswertung |
|---|---|---|---|
| Seiten | 65 | 175 | ~ 2,6 mal so viel |
| Wörter | 26.063 | 91.223 | ~ 3,5 mal so viel |
| Artikel | 50 | 92 | ~ 1,8 mal so viel |
- Struktur und Aufbau der MDR
- Wir geben einen kurzen Überblick über die Neustrukturierung der MDR und den jetzigen Aufbau. Darunter fallen auch Änderungen der Anhänge.
Quelle: https://www.johner-institut.de/blog/regulatory-affairs/medical-device-regulation-mdr-medizinprodukteverordnung/
- Wir geben einen kurzen Überblick über die Neustrukturierung der MDR und den jetzigen Aufbau. Darunter fallen auch Änderungen der Anhänge.
- Daten und Fristen
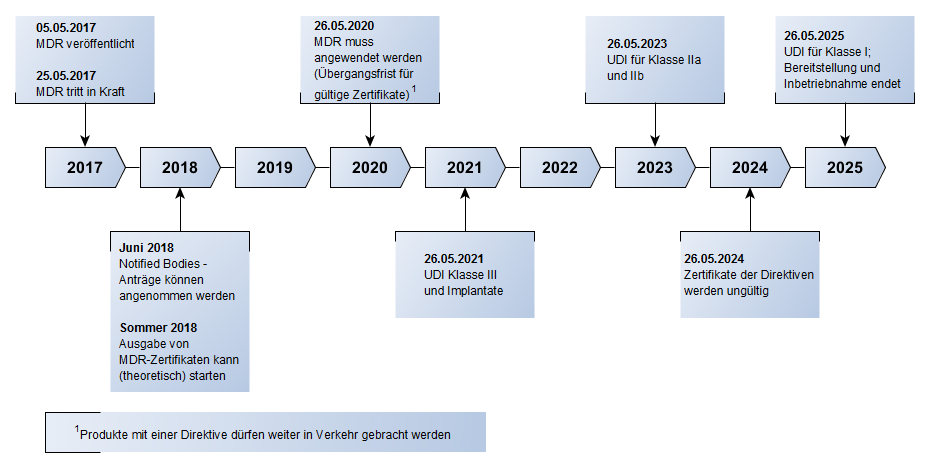
- Wir besprechen, bis wann die MDD gilt und ab wann die MDR greift und wie die Übergangsfristen für die Hersteller sind.
Alles ist in einem kleinen Zeitstrahl für euch zusammengefasst: - Quellen:
- Wir besprechen, bis wann die MDD gilt und ab wann die MDR greift und wie die Übergangsfristen für die Hersteller sind.
- MDR – Zeitstrahl – Fristen
- Grundlegende Anforderungen MDR (Anhang I)
- Ebenso erläutern wir die neuen “Essential Requirements” die durch die MDR nun gefordert werden.
Quelle: https://www.johner-institut.de/blog/tag/grundlegende-anforderungen/
- Ebenso erläutern wir die neuen “Essential Requirements” die durch die MDR nun gefordert werden.
- Unterschiede Anhang I MDD/MDR
- Wir erklären in ein paar Minuten die Änderungen bzw. Unterschiede zu den allgemeinen Anforderungen des Anhang I der MDD und der MDR.
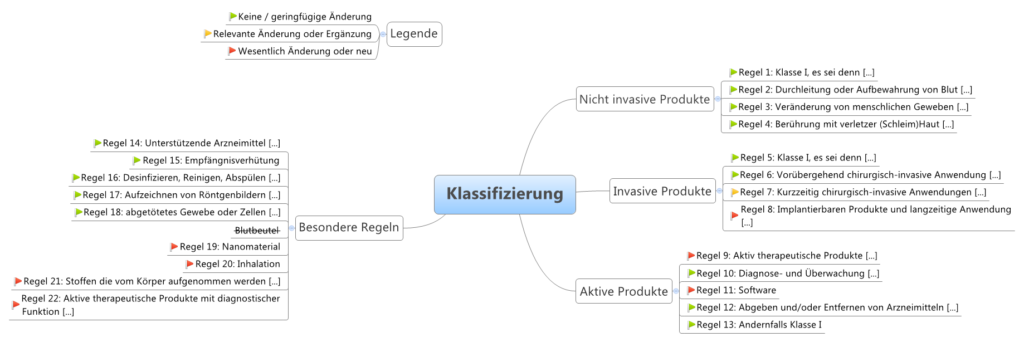
- Klassifizierung
- Wir besprechen, wie sich die Forderungen der MDR auf die Klassifizierung von Medizinprodukten auswirkt und was das für den Hersteller bedeuten kann.
- Auch hier ist die Klassifizierung nach MDR für euch in einer Mindmap aufbereitet:
Quelle: https://www.rnb-consulting.at/doku/doku.php/blog/2017/0512_mdr_teil_3_-_klassifizierungsregeln_rahmenbedingungen_fuer_die_anwendung_-_mdr_rl_93/42/ewg_im_vergleich
- Klassifizierung
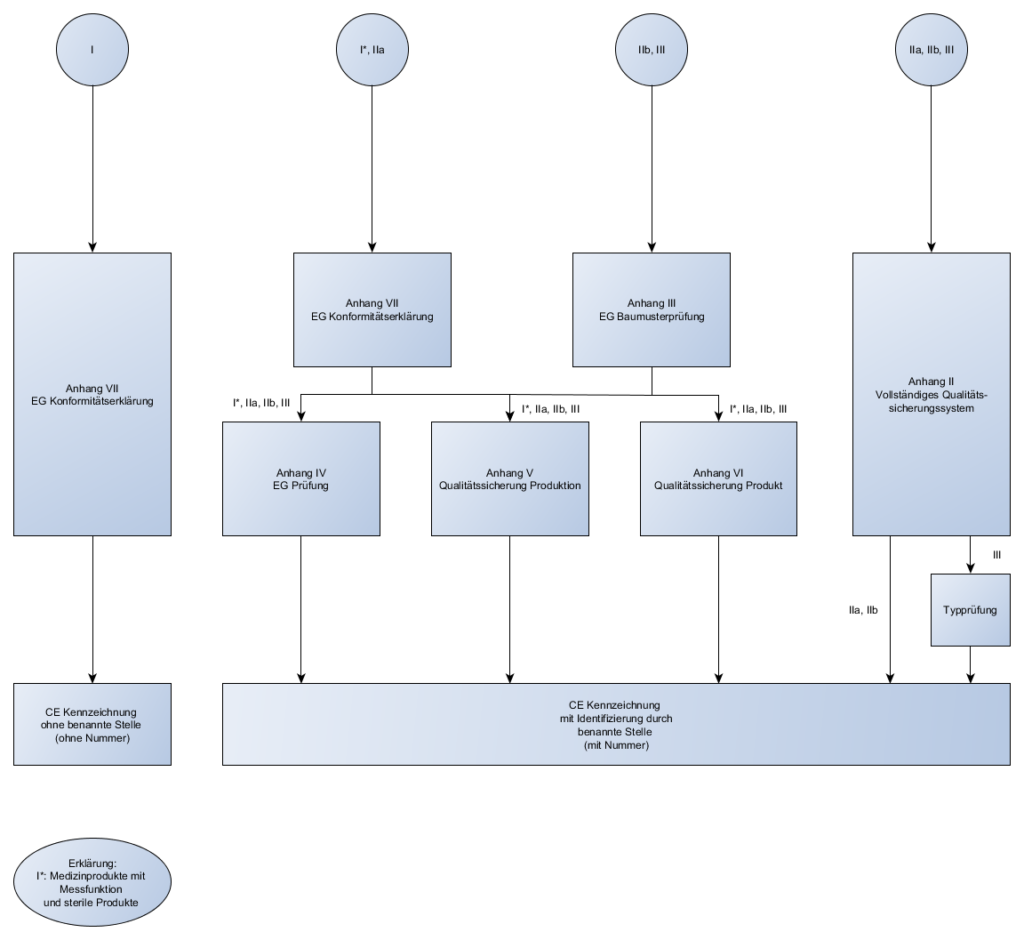
- Konformitätsbewertungsverfahren
- Es gibt es noch! Wie die Abläufe sind, je nach Klassifizierung des Medizinprodukts, zeigen wir euch in den nachfolgenden Bildern:
- MDD: Konformitätsbewertungsverfahren
- MDR: Konformitätsbewertungsverfahren
- Konsultationsverfahren (Scrutiny)
- Wir gehen auch auf das neue Scrutiny-Verfahren nach MDR ein und erläutern, welche Medizinprodukte es betrifft und wie der Ablauf des Verfahrens Einfluss auf das Inverkehrbringen hat.
Quelle: https://www.johner-institut.de/blog/regulatory-affairs/scrutiny/
- Wir gehen auch auf das neue Scrutiny-Verfahren nach MDR ein und erläutern, welche Medizinprodukte es betrifft und wie der Ablauf des Verfahrens Einfluss auf das Inverkehrbringen hat.
- Artikel 17: Einmalprodukte und ihre Aufbereitung
- Wie ihr hören könnt, ist uns dieser Artikel in die Augen gefallen und hat bereits für Diskussionsstoff gesorgt. Aber wieso und weshalb? Wir klären euch auf.
Quellen:
- Wie ihr hören könnt, ist uns dieser Artikel in die Augen gefallen und hat bereits für Diskussionsstoff gesorgt. Aber wieso und weshalb? Wir klären euch auf.
- Technische Dokumentation
- Wir erklären euch was die Technische Dokumentation ist, wozu sie dient und was sie alles enthalten muss.
Quelle: Christian Johner , Matthias Hölzer-Klüpfel , Sven Wittorf: Basiswissen Medizinische Software – Aus- und Weiterbildung zum Certified Professional for Medical Software, Auflage: 2, dpunkt.verlag, 2015
- Wir erklären euch was die Technische Dokumentation ist, wozu sie dient und was sie alles enthalten muss.
- CE Kennzeichnung
- Zum Abschluss gibt es noch einen kurzen Überblick über das CE Zeichen und was regularisch dahinter steckt.
weitere Quellen:
- https://www.tuev-sued.de/akademie-de/seminare-gesundheitswesen-und-medizintechnik/medizintechnik/medical-device-regulation-mdr
- https://www.tuev-sued.de/produktpruefung/branchen/medizinprodukte/marktzulassung-und-zertifizierung/eu-marktzugang/mdr-eu-medizinprodukteverordnung
- https://www.tuev-sued.de/produktpruefung/mehrwert-fuer-sie/newsletter-e-ssentials/e-ssentials-medizinprodukte/e-ssentials-juli-2016/video-neue-mdr
- http://www.pharma-life-science.de/de_DE/vergleich-der-medizinprodukteverordnung-mdr-mit-der-medizinproduktrichtlinie-mdd/
Wenn ihr uns unterstützen wollt und euch gefallen hat, was wir in dieser Episode erzählt haben oder Ihr Fragen und Anregungen habt, schreibt uns doch einen Kommentar in diesen Blog.
Ihr könnt uns auch über eine kleine Spende unterstützen. Das hält den Podcast weiter am Leben





Schreibe einen Kommentar