In der ersten Episode dieses Podcasts geht es darum, wie die Rechtslage in Europa aussieht.
Folgende Fragen sollen beantwortet werden:
- Was muss ein Medizinproduktehersteller beachten, um seine Produkte in Verkehr zu bringen?
- Welche Verordnungen, Richtlinien und Normen müssen eingehalten werden?
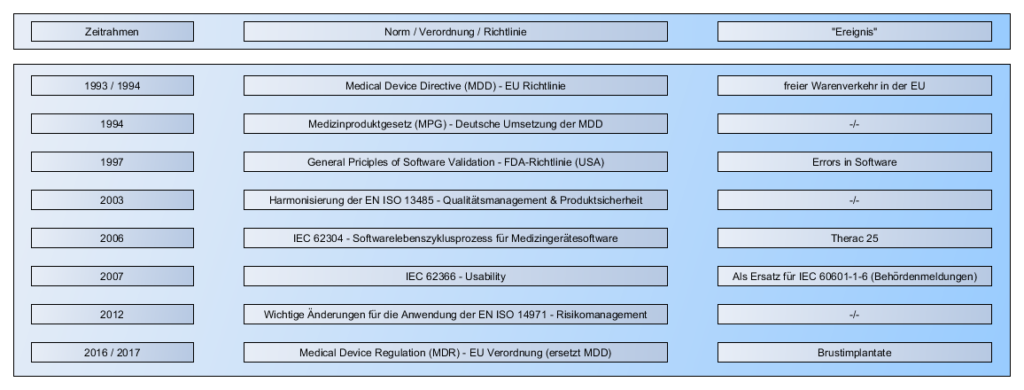
Anhand eines Zeitstrahls erläutern wir zu Beginn, wie sich gewisse Regularien mit der Zeit entwickelt haben und erklären beispielhaft welche Ereignisse Einfluss auf die Regularien genommen haben.
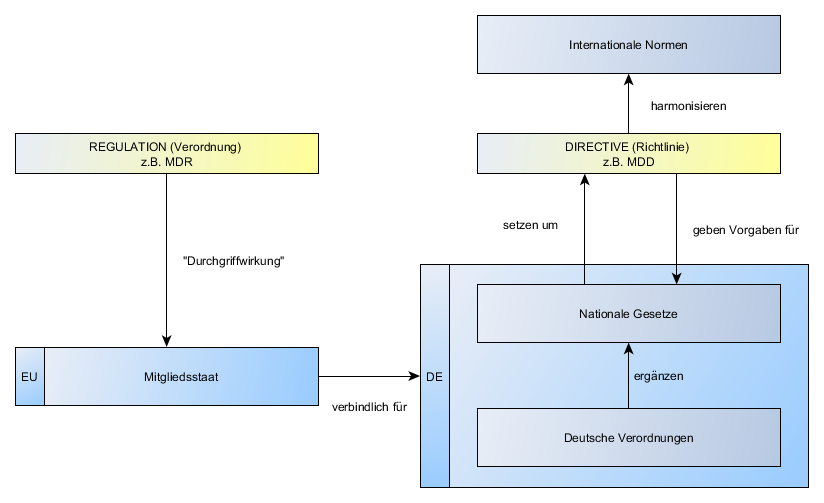
Wir erläutern ein paar Unterschiede zwischen der europäischen Richtlinie “Medical Device Directive (MDD)” und der neuen Verordnung “Medical Device Regulation (MDR)“.
In dem letzten Abschnitt geben wir einen Überblick über die häufig anzuwendenden Normen:
| Nummer | Gremium | Titel | Link zur ISO/IEC Homepage | Link zur Wikipedia |
|---|---|---|---|---|
| 13485 | ISO | Medizinprodukte - Qualitätsmanagementsysteme - Anforderungen für regulatorische Zwecke | ISO 13485 | ISO 13485 (wikipedia) |
| 60601‑1 | IEC | Medizinische elektrische Geräte - Teil 1: Allgemeine Festlegungen für die Sicherheit einschließlich der wesentlichen Leistungsmerkmale | IEC 60601-1 | IEC 60601-1 |
| 14971 | ISO | Medizinprodukte - Anwendung des Risikomanagements auf Medizinprodukte | ISO 14971 | ISO 14971 |
| 62304 | IEC | Medizingeräte-Software - Software-Lebenszyklus-Prozesse | IEC 62304 | IEC 62304 (en) |
| 82304 | IEC | Gesundheitssoftware - Teil 1: Allgemeine Anforderungen für die Produktsicherheit | IEC 82304 | Stand April 2018: Kein Wikipedia Artikel |
| 62366 | IEC | Anwendung der Gebrauchstauglichkeit auf Medizinprodukte | IEC 62366 | IEC 62366 |
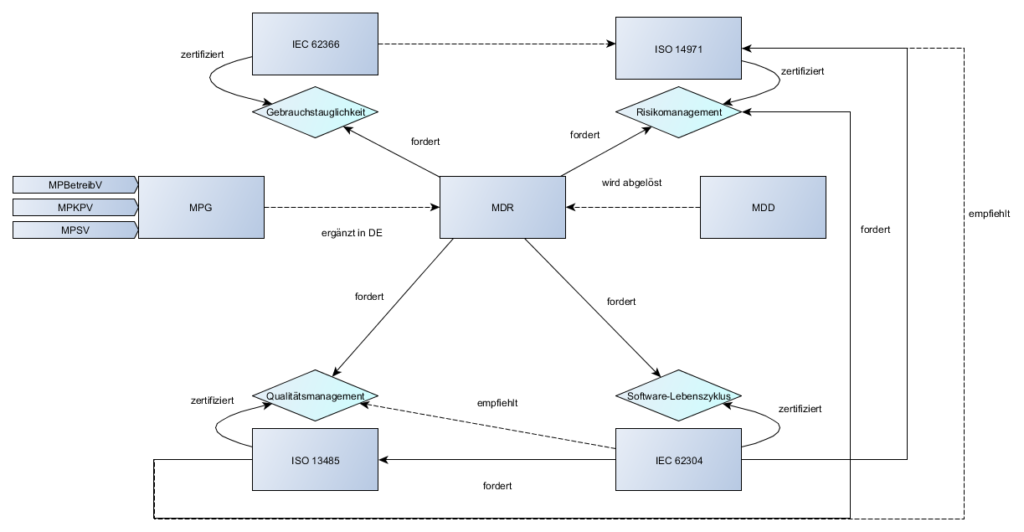
Wie auf den Bildern zu sehen und in der Episode zu hören ist, wird an verschiedenen Stellen ein Qualitätsmanagement und Risikomanagement gefordert. Damit wird uns die ISO 13485 (Qualitätsmanagement) und die ISO 14971 (Risikomanagement) in weiteren Episoden begleiten.
In den Bildern findet Ihr folgendes:
- Zeitstrahl: Beispielhafte zeitliche Entwicklung der Regularien
- Beziehung zwischen der MDD, MDR und Nationalen Gesetzen und was das für den Medizinproduktehersteller bedeutet
- Beziehungen zwischen der MDR und den häufig anzuwendenden Normen
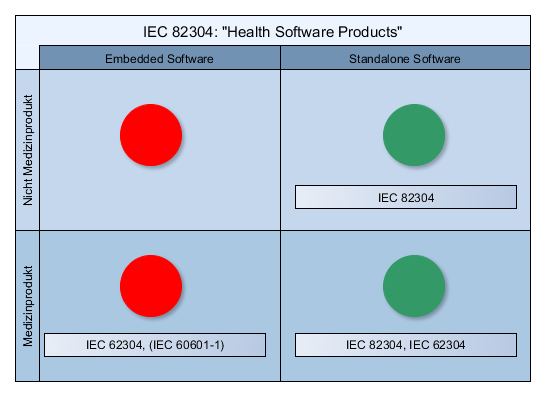
- Übersicht: Neue Norm IEC 82306 für Standalone Software
- Zeitstrahl
- Regulation vs. Directive
- Normenbeziehungen
- IEC 82304
Quellen:
- Christian Johner , Matthias Hölzer-Klüpfel , Sven Wittorf: Basiswissen Medizinische Software – Aus- und Weiterbildung zum Certified Professional for Medical Software, Auflage: 2, dpunkt.verlag, 2015
- https://www.johner-institut.de/blog/regulatory-affairs/medical-device-regulation-mdr-medizinprodukteverordnung/
- https://www.devicemed.de/index.cfm?pid=10749&pk=579129&fk=1169186&type=article




Schreibe einen Kommentar